9th Class Physical Science (ଭୌତିକ ବିଜ୍ଞାନ) - Chapter 3 ପରମାଣୁ ଓ ଅଣୁ All Question With Answer
↓ Question & Answer ↓
ଉ-
ରାସାୟନିକ ସଂଯୋଗର ଦୁଇଟି ନିୟମ ହେଲା- ବସ୍ତୁତ୍ଵ ସଂରକ୍ଷଣ ନିୟମ ଓ ସ୍ଥିରାନୁପାତ ନିୟମ ।
ବସ୍ତୁତ୍ଵ ସଂରକ୍ଷଣ ନିୟମ :
- ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ବସ୍ତୁତ୍ଵର ସୃଷ୍ଟି ନାହିଁ କିମ୍ବା ବିନାଶ ନାହିଁ ।
- ଯେତେବେଳେ ଏକ ରାସାୟନିକ ପରିବର୍ତ୍ତନ ବା ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଘଟେ, ସେତେବେଳେ ବସ୍ତୁତ୍ଵର ପରିବର୍ତ୍ତନ ଘଟିନଥାଏ । ଅର୍ଥାତ୍ ପରିବର୍ତ୍ତନର ପୂର୍ବ-ବସ୍ତୁତ୍ଵ ଓ ପର-ବସ୍ତୁତ୍ଵ
ସମାନ ରହିଥାଏ ।
ଉଦାହରଣ – 2 ଗ୍ରାମ୍ ଉଦ୍ଜାନ 71 ଗ୍ରାମ୍ କ୍ଲୋରିନ୍ ସହ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କଲେ 73 ଗ୍ରାମ୍ ହାଇଡ୍ରୋଜେନ୍ କ୍ଲୋରାଇଡ୍ ଉତ୍ପନ୍ନ ହୁଏ ।
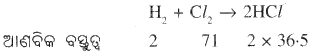
ଉପରୋକ୍ତ ସମୀକରଣରୁ ସ୍ପଷ୍ଟ ହୁଏ ଯେ ପ୍ରତିକାରକଗୁଡ଼ିକର ମୋଟ ବସ୍ତୁତ୍ୱ ଉତ୍ପାଦଗୁଡ଼ିକର ମୋଟ ବସ୍ତୁତ୍ଵ ସହ ସମାନ |
ସ୍ଥିରାନୁପାତ ନିୟମ :
- ରାସାୟନିକ ଯୌଗିକରେ ମୌଳିକଗୁଡ଼ିକ ସର୍ବଦା ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ବସ୍ତୁତ୍ଵ ଅନୁପାତରେ ରହିଥାଏ ।
- କୌଣସି ଏକ ଯୌଗିକ ପଦାର୍ଥ ଯେପରି ପ୍ରସ୍ତୁତ ହେଉ ନା କାହିଁକି କିମ୍ବା ଯେକୌଣସି ଉତ୍ସରୁ ମିଳିଥାଉ, ସେଥୁରେ ସମାନ ମୌଳିକଗୁଡ଼ିକ ସର୍ବଦା ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ବସ୍ତୁତ୍ନୁ
ପାତରେ ସଂଯୁକ୍ତ ହେବାଦ୍ଵାରା ତାହା ସୃଷ୍ଟି ହୋଇଥାଏ ।
ଉଦାହରଣ :
- ଜଳକୁ ଯେକୌଣସି ଉତ୍ସରୁ ସଂଗ୍ରହ କଲେ ମଧ୍ୟ ଜଳରେ ସର୍ବଦା ହାଇଡ୍ରୋଜେନ୍ ଓ ଅକ୍ସିଜେନ୍ 1: 8 ବସ୍ତୁତ୍ୱ ଅନୁ ପାତରେ ସଂଯୁକ୍ତ ହୋଇଥାଏ । ୨ ଗ୍ରାମ୍ ଜଳକୁ ବିଘଟନ
କଲେ ସର୍ବଦା । ଗ୍ରାମ୍ ହାଇଡ୍ରୋଜେନ୍ ଏବଂ ୫ ଗ୍ରାମ୍ ଅକ୍ସିଜେନ୍ ମିଳିଥାଏ ।
- କାର୍ବନ ଡାଇଅକ୍ସାଇଡ଼କୁ ଯେକୌଣସି ପ୍ରଣାଳୀରେ ପ୍ରସ୍ତୁତ କରାଯାଉ କିମ୍ବା ଯେକୌଣସି ଉତ୍ସରୁ ସଂଗ୍ରହ କରାଯାଉ, ସେଥ୍ରେ କାର୍ବନ ଓ ଅକ୍ସିଜେନ୍ର ବସ୍ତୁତ୍ଵର ଅନୁପାତ ସର୍ବଦା
3 : 8 ହେବ ।
ଡାଲ୍ନ୍ଙ୍କ ପରମାଣୁ ତତ୍ତ୍ବ : ବୈଜ୍ଞାନିକ ଜନ୍ ଡାଲ୍ଟନ୍ 1808 ମସିହାରେ ପଦାର୍ଥର ଗଠନ ସଂପର୍କରେ ଏକ ନୂତନ ତତ୍ତ୍ଵ ଉପସ୍ଥାପନ କରିଥିଲେ । ଏହାକୁ ଡାଲ୍ଟନ୍ ଙ୍କ ପରମାଣୁ ତତ୍ତ୍ୱ କୁହାଯାଏ । ଏହି ତତ୍ତ୍ଵର ସ୍ଵୀକାରଗୁଡ଼ିକ
ହେଲା –
- ପଦାର୍ଥ ଅନେକଗୁଡ଼ିଏ ଅତି କ୍ଷୁଦ୍ର କଣିକାଦ୍ଵାରା ଗଠିତ । ସେହି କଣିକାକୁ ପରମାଣୁ କୁହାଯାଏ ।
- ପରମାଣୁଗୁଡ଼ିକ ଅବିଭାଜ୍ୟ କଣିକା, ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଏହାକୁ ସୃଷ୍ଟି କରାଯାଇପାରିବ ନାହିଁ କିମ୍ବା ବିନାଶ କରାଯାଇପାରିବ ନାହିଁ ।
- କୌଣସି ଏକ ମୌଳିକର ପରିମାଣୁଗୁଡ଼ିକର ବସ୍ତୁତ୍ଵ ଓ ରାସାୟନିକ ଧର୍ମ ସମାନ ।
- ବିଭିନ୍ନ ମୌଳିକର ପରମାଣୁଗୁଡ଼ିକର ବସ୍ତୁତ୍ଵ ଓ ରାସାୟନିକ ଧର୍ମ ଭିନ୍ନ ହୋଇଥାଏ ।
- ଛୋଟ ପୂର୍ଣ୍ଣସଂଖ୍ୟା ଅନୁପାତରେ ବିଭିନ୍ନ ମୌଳିକର ପରମାଣୁଗୁଡ଼ିକ ସଂଯୁକ୍ତ ହୋଇ ଯୌଗିକ ସୃଷ୍ଟି ହୋଇଥାଏ ।
ଉ –
ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ ଏକକରେ ମୌଳିକର ପରମାଣୁର ହାରାହାରି ବସ୍ତୁତ୍ଵ ହେଉଛି ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ |
ଉଦାହରଣ : ପ୍ରକୃତିରେ ଉପଲବ୍ଧ ଅକ୍ସିଜେନ୍ର ଆଇସୋଟୋପ୍ଗୁଡିକ ହେଲା- 160, 170 ଓ 180 1 ସେଗୁଡିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ଯଥାକ୍ରମେ 15.995 u, 16.999 u ଓ 17.999 u । ଏହି ଆଇସୋଟୋପ୍ଗୁଡିକର ଆପେକ୍ଷିକ ପରିମାଣ ଯଥାକ୍ରମେ 99.763%, 0.037% ଓ 0.200% |
∴ ଅମ୍ଳଜାନର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ =\frac{99.762*15.995+0.037*16.999+0.200-17.999}{100}= 15.999u = 16u |
ଉ –
ଆଣବିକ ବସ୍ତୁତ୍ଵ : ଆଣବିକ ବସ୍ତୁତ୍ଵ ହେଉଛି, ଗୋଟିଏ ଅଣୁରେ ଥିବା ସମସ୍ତ ପରମାଣୁର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ଯୋଗଫଳ । ଆଣବିକ ବସ୍ତୁତ୍ଵ ଏକ ଆନୁପାତିକ ସଂଖ୍ୟା ଏବଂ ଏହାର ଏକକ u ।
ଉଦାହରଣ :
କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍ର ଆଣବିକ ବସ୍ତୁତ୍ଵ ନିର୍ଣ୍ଣୟ :
କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍ର ସଂକେତ = CO2
କାର୍ବନର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = 12u,
ଅକ୍ସିଜେନ୍ର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ଼ର ଆଣବିକ ବସ୍ତୁତ୍ଵ = 16u
∴ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍ର ଆଣବିକ ବସ୍ତୁତ୍ଵ
= 1 x କାର୍ବନର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ + 2 x ଅକ୍ସିଜେନ୍ର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ
= 1 × 12u + 2 × 16u = 12u + 32 u = 44u
ଉ –
ପଲିଆଟମିକ୍ ଆୟନ : ଗୋଟିଏ ଚାର୍ଜଯୁକ୍ତ ପରମାଣୁରେ ଆୟନ ଗଠିତ ହୋଇପାରେ କିମ୍ବା ଏକାଧ୍ଵ ପରମାଣୁ ଏକତ୍ର ହୋଇ ଯୁକ୍ତ ବା ବିଯୁକ୍ତ ଚାର୍ଜ ବହନ କରିପାରେ । ଏକାଧିକ ପରମାଣୁ ଏକତ୍ର ହୋଇ ଚାର୍ଜ ବହନ କରିଥିଲେ ସେଗୁଡ଼ିକୁ ପଲିଆଟମିକ୍ ଆୟନ କୁହାଯାଏ ।
ଉଦାହରଣ –
| ପଲିଆଟମିକ୍ ଆୟନର ନାମ | ସଙ୍କେତ |
|---|---|
| ଏମୋନିୟମ୍ ଆୟନ | (NH4+) |
| ହାଇଡ୍ରୋକ୍ସାଇଡ୍ ଆୟନ | (OH-) |
| ନାଇଟ୍ରେଟ୍ ଆୟନ | (NO3-) |
| କାର୍ବୋନେଟ୍ ଆୟନ | (CO3--) |
(i) ବେରିୟମ୍ (ii) ବେରିଲିୟମ୍ (iii) କ୍ୟାଡ୍ମିୟମ୍ (iv) କ୍ରୋମିୟମ୍ (v) ଗୋଲ୍ଡ
Ans:
(i) ବେରିୟମ୍: → Ba
(ii) ବେରିଲିୟମ୍: → Be
(iii) କ୍ୟାଡ୍ମିୟମ୍: → Cd
(iv)କ୍ରୋମିୟମ୍: → Cr
(v)ଗୋଲ୍ଡ: → Au
(i) Al (ii) He (iii) Co (iv) Mn (v) Hg (vi) B (vii) P (viii) S (ix) C (x) F
| ପ୍ରତିକ | ରସାୟନିକ ନାମ |
|---|---|
| (i) Al | ଏଲୁମିନିୟମ୍ |
| (ii) He | ହିଲିୟମ୍ |
| (iii) Co | କୋବାଲଟ |
| (iv) Mn | ମାଙ୍ଗାନିଜ |
| (v) Hg | ପାରଦ |
| (vi) B | ବୋରନ୍ |
| (vii) P | ଫସଫରସ୍ |
| (viii) S | ସଲଫର୍ |
| (ix) C | କାର୍ବନ୍ |
| (x) F | ଫ୍ଲୋରିନ୍ |
ଉ –
ରାସାୟନିକ ସଂକେତ ଲେଖୁବାର ପ୍ରଣାଳୀ : ରାସାୟନିକ ସଂକେତ ଲେଖୁବେଳେ ନିମ୍ନଲିଖ୍ତ ନିୟମମାନ ଅବଲମ୍ବନ କରାଯାଏ ।
- ଯୌଗିକ ଅଣୁର ସଂକେତ ଲେଖିବାକୁ ହେଲେ ପ୍ରଥମେ ଏଥିରେ ଥବା ମୌଳିକଗୁଡ଼ିକର ପ୍ରତୀକକୁ ପାଖାପାଖି ଲେଖାଯାଏ ।
(i) ସୋଡ଼ିୟମ୍ କ୍ରୋମାଇଡ୍ (ii) ଜିଙ୍କ୍ ସଲଫେଟ୍ (iii) ଏମୋନିୟମ୍ କ୍ଲୋରାଇଡ୍ (iv) ବେରିୟମ୍ କାର୍ବୋନେଟ୍ (v) ଏଲୁମିନିୟମ୍ ଫସ୍ଫେଟ୍
Ans:

ଏଭୋଗାଡ୍ରୋ ସ୍ଥିରାଙ୍କ :
(i) ଏକ ମୋଲ୍ କହିଲେ 6.02 x 1023 ସଂଖ୍ୟାକୁ ବୁଝାଏ । ଏହି ବିରାଟ ସଂଖ୍ୟାକୁ ଏଭୋଗାଡ୍ରୋ ସ୍ଥିରାଙ୍କ ବା ଏଭୋଗାଡ୍ରୋ ସଂଖ୍ୟା କୁହାଯାଏ । ଏହାକୁ N0 ପ୍ରତୀକଦ୍ଵାରା ଚିହ୍ନିତ କରାଯାଏ ।
1 N0 = 6.02 x 1023 ସଂଖ୍ୟାକ କଣିକା |
(ii) ଏହା ଅଣୁ, ପରମାଣୁ, ଆୟନ ବା କଣିକା ସଂଖ୍ୟା ଗଣନାର ଗୋଟିଏ ଏକକ ।
ଉଦାହରଣ –
1 ମୋଲ୍ ହାଇଡ୍ରୋଜେନ୍ ପରମାଣୁ = 6:02 x 1023 ସଂଖ୍ୟକ ହାଇଡ୍ରୋଜେନ୍ ପରମାଣୁ
1 ମୋଲ୍ କ୍ଲୋରିନ୍ ଅଣୁ = 6:02 x 1023 ସଂଖ୍ୟକ କ୍ଲୋରିନ୍ ଅଣୁ ।
1 ମୋଲ୍ ଆୟନ = 6-02 x 1023 ସଂଖ୍ୟକ ଆୟନ ।
1 ମୋଲ୍ ଇଲେକ୍ଟ୍ରନ୍ = 6.02 × 1023 ସଂଖ୍ୟକ ଇଲେକ୍ଟ୍ରନ୍ |
ଉ-
ଗ୍ରାମ୍-ଆଣବିକ ବସ୍ତୁତ୍ଵ : ଏକ ମୋଲ୍ ପଦାର୍ଥର ବସ୍ତୁତ୍ଵକୁ ‘ମୋଲାର ବସ୍ତୁତ୍ଵ’ କୁହାଯାଏ । ପରମାଣୁର
ମୋଲାର ବସ୍ତୁତ୍ଵକୁ ଗ୍ରାମ୍-ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ଏବଂ ଅଣୁର ମୋଲାର ବସ୍ତୁତ୍ଵକୁ ଗ୍ରାମ-ଆଣବିକ ବସ୍ତୁତ୍ଵ କୁହାଯାଏ ।
ଉଦାହରଣ –
- ମିଥେନର CH 4 ଆଣବିକ ବସ୍ତୁତ୍ଵ = 16u
- ମିଥେନର ଗ୍ରାମ୍-ଆଣବିକ ବସ୍ତୁତ୍ଵ = 16 ଗ୍ରାମ୍
- => 16 ଗ୍ରାମ୍ ମିଥେନ୍ ରେ 1 ମୋଲ୍ ମିଥେନ୍ ଅଣୁ ଅର୍ଥାତ୍ 6.02 x 1023 ସଂଖ୍ୟକ ମିଥେନ୍ ଅଣୁ ରହିଛି